I en verden full av kjemiske krefter og bindinger, er det én spesiell form for binding som fanger oppmerksomheten vår – ionebindingen. Men hva er egentlig denne mystiske bindingen? I denne artikkelen vil vi utforske konseptet rundt hva ionebinding er, hvordan det oppstår, og hvilke egenskaper denne bindingen besitter. Hold på lesebrillene, for vi drar inn i den kjemiske verden for å forstå ionebinding på en informativ og nøytral måte.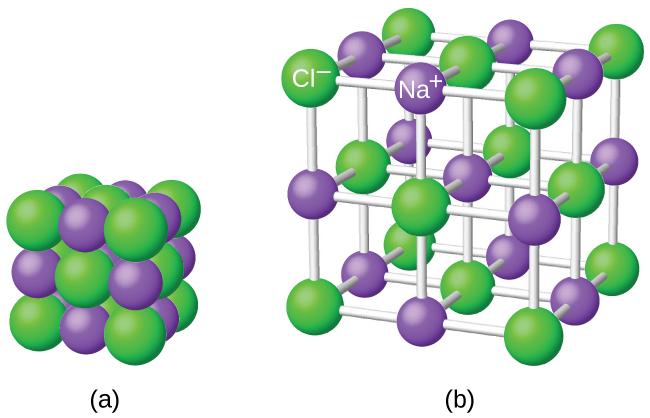
Hva er ionebinding?
Ionebinding er en type kjemisk binding som oppstår mellom to ioner med motsatt ladning. Ioner er atomer eller molekyler som har fått en positiv eller negativ ladning ved å miste eller få elektroner. Ionebindingen oppstår når et atom med lav elektronegativitet, som et metall, avgir en eller flere elektroner til et atom med høyere elektronegativitet, som et ikke-metall. Denne overføringen av elektroner skaper en elektrostatisk tiltrekning mellom de motsatte ladningene, og danner dermed en stabil forbindelse.
Ionebinding er kjent for å danne sterke forbindelser på grunn av den store elektrostatiske tiltrekningen mellom ionene. Her er noen viktige egenskaper ved ionebindinger:
- Ioniske forbindelser dannes vanligvis mellom metaller og ikke-metaller.
- De har høye smelte- og kokepunkter på grunn av de sterke bindingene mellom ionene.
- Ionebindinger er ofte sprø og harde, som for eksempel saltkrystaller.
- De leder elektrisitet når de er i smeltet form eller i vannløsninger, men ikke som faste stoffer.
- Ioniske forbindelser danner ofte krystallstrukturer på grunn av måten ionene ordner seg på i gitteret.
For å illustrere dette kan vi se på et eksempel på en ionisk forbindelse, som natriumklorid (NaCl). Natriumatomet mister ett elektron og blir en positivt ladd ion (Na+), mens kloratomet mottar dette elektronet og blir en negativt ladet ion (Cl-). Disse motsatte ladningene tiltrekker hverandre og danner en stabil forbindelse i form av krystallinske saltkrystaller.
Ioners rolle i ionebinding
Ionebinding er en type kjemisk binding som oppstår mellom ioner. Ionene er atomer eller molekyler som har fått en positiv eller negativ ladning ved å miste eller få elektroner. Ioner med motsatt ladning tiltrekkes hverandre, og dette fører til dannelse av ionebindinger.
Ioner spiller en viktig rolle i ionebinding ved å bidra til dannelse av stabile forbindelser. Positivt ladede ioner kalles kationer, og negativt ladede ioner kalles anioner. Når et kation og et anion tiltrekker hverandre, dannes en ionebinding mellom dem.
Ionebindinger har flere egenskaper og påvirker egenskapene til stoffene som dannes. Noen av egenskapene inkluderer høy smelte- og kokepunkt, gode ledningsevne for elektrisitet og evnen til å løses i vann. Disse egenskapene gjør ionebindinger viktige i mange forskjellige kjemiske forbindelser som salter og metallforbindelser.
I tabellen nedenfor oppsummeres noen eksempler på kjemiske forbindelser dannet av ionebindinger:
| Forbindelse | Kation | Anion |
|---|---|---|
| Natriumklorid (NaCl) | Natrium (Na+) | Klor (Cl–) |
| Kalsiumoksid (CaO) | Kalsium (Ca2+) | Oksygen (O2-) |
| Bariumsulfat (BaSO4) | Barium (Ba2+) | Sulfat (SO42-) |
Som du kan se, har hver forbindelse bestemte kationer og anioner som tiltrekker seg hverandre for å danne stabile ionebindinger. Disse bindingene gir stoffene deres karakteristiske egenskaper og er avgjørende for mange kjemiske reaksjoner og prosesser. Derfor spiller ionene en viktig rolle i ionebinding.
Anvendelser av ionebinding
Ionebinding er en viktig kjemisk binding som oppstår mellom positivt og negativt ladede ioner. Denne typen binding er vanlig i mange kjemiske forbindelser og spiller en sentral rolle i mange anvendelser.
En av de mest kjente anvendelsene av ionebinding er i saltproduksjon. Ved å kombinere natriumioner (Na+) med klorioner (Cl-), dannes natriumklorid (NaCl) som er kjent som vanlig bordsalt. Salt brukes ikke bare som smakstilsetning i matlaging, men også i konservering, frysing og til og med i medisin.
I tillegg til saltproduksjon er ionebinding også viktig i keramikkproduksjon. Keramikk inneholder gjerne ioniske forbindelser som gir materialet dets spesielle egenskaper. For eksempel kan ionebindingen mellom oksygenioner (O2-) og aluminiumioner (Al3+) i forbindelsen aluminosilikat gi keramikk styrke og varmemotstand.
I tillegg til disse anvendelsene spiller ionebinding en viktig rolle i mange andre områder inkludert elektrisk ledningsevne, batteriteknologi, vannrensing og farmasøytisk produksjon. Det er fascinerende å se hvordan denne enkle kjemiske bindingen har så mange praktiske og nyttige anvendelser i ulike bransjer og mellommenneskelige liv.
Endelige tanker
Takk for at du tok deg tid til å lese denne artikkelen om hva ionebinding er. Vi håper at du nå har en bedre forståelse av denne fundamentale kjemiske bindingstypen og dens betydning i ulike forbindelser. Ionebinding er en prosess der positivt og negativt ladede ioner tiltrekker hverandre, noe som resulterer i dannelse av ioniske forbindelser. Dette skjer når et eller flere atomer mister eller får elektroner for å oppnå stabilitet.
Ionebinding er a avgjørende for mange kjemiske reaksjoner og forekommer i en rekke materialer og forbindelser, inkludert salter, mineraler og til og med løsninger som er avgjørende for biologiske prosesser. Det gir også opphav til egenskaper som høysmeltepunkt, god termisk ledningsevne og elektrisk ledningsevne i mange materialer.
Vi håper at denne artikkelen har klargjort hva ionebinding er og hvordan den spiller en viktig rolle i kjemiens verden. For mer informasjon anbefales det å lese videre om relaterte emner som kjemisk binding og molekylære strukturer.